我校陶玉貴教授團隊與安徽醫(yī)科大學(xué)裴佩副教授和蘇州大學(xué)放射醫(yī)學(xué)與輻射防護國家重點實驗楊凱教授合作,利用X射線協(xié)助CD11b+免疫細(xì)胞遞送納米酶涂層的細(xì)菌調(diào)控腫瘤微環(huán)境以增強腫瘤免疫治療取得了突破性研究進展,相關(guān)成果以“Nanozyme-coated bacteria hitchhike on CD11b+ immune cells to boost tumor radio-immunotherapy”為題發(fā)表在《Advanced Materials》(中科院一區(qū),IF:29.4)上。安徽工程大學(xué)為該論文第一通訊作者單位,生物與食品工程學(xué)院2023屆研究生李航航為論文第一作者。
基于細(xì)菌的藥物遞送策略由于其可基因工程、物理化學(xué)修飾與免疫激活特性等,近年來在腫瘤治療方面受到了廣泛的關(guān)注。然而,無論是活細(xì)菌還是滅活細(xì)菌載體在進入體內(nèi)后大部分會被免疫細(xì)胞吞噬并逐漸清除,這大大降低了基于細(xì)菌載體的遞送效率。而利用免疫細(xì)胞(如巨噬細(xì)胞、中性粒細(xì)胞等)的趨炎效應(yīng)實現(xiàn)對載體的靶向遞送已經(jīng)被證明是可行的,其不僅能夠提高藥物遞送的效率,還能降低對正常組織的副作用。因此,在合適的時機借助吞噬類免疫細(xì)胞對微米級細(xì)菌載體進行增強遞送可能是一個有效的策略,以優(yōu)化基于細(xì)菌的遞送方法。
放療作為腫瘤治療的最常用手段之一,除了可以直接通過高能電離輻射殺死或損傷腫瘤細(xì)胞外,還可以引起腫瘤局部產(chǎn)生更強烈的炎癥反應(yīng)從而招募更多的免疫細(xì)胞。因此,或許可以利用X射線產(chǎn)生的腫瘤炎癥來進一步提高免疫細(xì)胞對細(xì)菌載體的遞送。
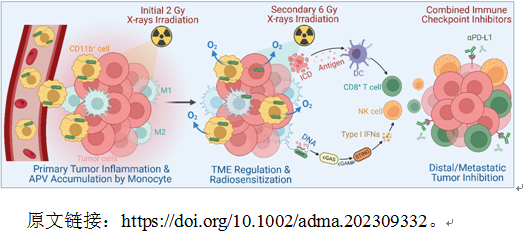
在前期的實驗中,團隊人員偶然發(fā)現(xiàn)尾靜脈注射的微米級的滅活VNP20009細(xì)菌載體也可以在腫瘤部位富集,通過流式細(xì)胞術(shù)分析發(fā)現(xiàn)滅活VNP20009細(xì)菌進入體內(nèi)后主要被CD11b+免疫細(xì)胞內(nèi)吞,并上調(diào)血液中CD11b+免疫細(xì)胞的比例。因此,團隊人員推測在腫瘤富集的VNP20009細(xì)菌可能主要是通過CD11b+免疫細(xì)胞的趨炎作用從而搭乘便車至腫瘤部位。基于上述觀點,團隊人員隨后設(shè)計并通過一步還原法制備了雙金屬納米酶涂層的VNP20009細(xì)菌載體(Au-Pt@ VNP20009,APV),在體外驗證了APV的特性(高CAT活性、放療增敏效應(yīng)與激活cGAS-STING通路)。在體內(nèi),利用2 Gy X射線預(yù)照射引起更強的腫瘤炎癥,進一步協(xié)助增強趨炎類免疫細(xì)胞對APV的遞送效率。通過流式細(xì)胞術(shù)和IVIS熒光成像驗證了X射線協(xié)助APV搭乘CD11b+免疫細(xì)胞的便車增強腫瘤靶向遞送策略的可行性。當(dāng)APV被協(xié)助遞送至腫瘤后,可以有效解除腫瘤缺氧微環(huán)境并促進巨噬細(xì)胞M1極化和DC細(xì)胞成熟,從而提高放療療效與抗腫瘤免疫反應(yīng)。最后,在聯(lián)合6 Gy放療和αPD-L1后可以促進CD8+ T細(xì)胞與NK細(xì)胞在腫瘤的浸潤,顯著抑制腫瘤的生長和轉(zhuǎn)移。總之,本研究成功利用X射線協(xié)助增強微米級納米酶涂層細(xì)菌載體的腫瘤靶向遞送并闡明了其中機理,為優(yōu)化細(xì)菌基載體的遞送策略開辟了新方法,同時為多功能細(xì)菌載體與腫瘤放射免疫治療的有機結(jié)合提供了新思路。
《Advanced Materials》是材料學(xué)科大領(lǐng)域,包含材料化學(xué),材料物理,生物材料,納米材料,光電材料,金屬材料,無機非金屬材料,電子材料等子學(xué)科的頂尖期刊。在國際材料領(lǐng)域科研界上享譽盛名,其接收率只有10%-15%,影響因子達到29.4。
(文:張偉偉;圖:李航航;審核:張國強)
